La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
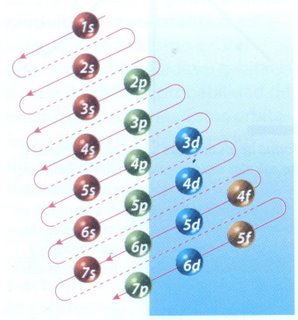
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:

La flecha indica el valor del cuarto número cuántico, el de spin: para +1/2: y para –1/2, respectivamente.
También podemos describir la distribución de electrones en el átomo de litio como:

También podemos describir la distribución de electrones en el átomo de litio como:

no m sirvio
ResponderEliminarNo hay alguna foto específica de la configuración vectorial
ResponderEliminar