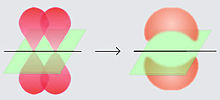
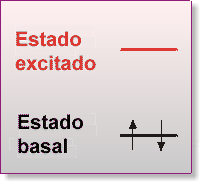
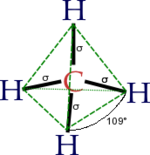
Griegos
<<Tradicionalmente se afirma que el fundador de la escuela atomista fue el filósofo Leucipo. Sabemos muy poco de su vida, tan poco que se ha llegado a afirmar que quizá nunca existió. Sea como fuere, quien verdaderamente dio cuerpo a la teoría atomista fue Demócrito. ¿Cómo surgió la teoría?
En tiempos de Demócrito, allá por el siglo V a.C., las distintas escuelas filosóficas se encontraban divididas básicamente en dos: la que consideraba que todo está en permanente cambio y que, por tanto, nada permanece constante; y la que afirmaba que la realidad en su conjunto es estática y que, aunque pueda parecer lo contrario, en el fondo nada cambia nunca. Heráclito se llamó el filósofo que defendió la primera teoría y Parménides quien defendió la opuesta. La teoría de Parménides nos recuerda a ese principio fundamental de la física que dice que "la materia no se crea ni se destruye, sólo se transforma", es decir, que en el fondo la realidad siempre es la misma. >>
Dalton
Las leyes ponderales de las combinaciones químicas encontraron una explicación satisfactoria en lateoría atómica formulada por DALTON en 1803 y publicada en 1808. Dalton reinterpreta las leyes ponderales basándose en el concepto de átomo. Establece los siguientes postulados o hipótesis,partiendo de la idea de que la materia es discontinua:
Los elementos están constituidos por átomos consistentes en partículas materiales separadas e indestructibles;
Los átomos de un mismo elemento son iguales en masa y en todas las demás cualidades.
Los átomos de los distintos elementos tienen diferentes masa y propiedades
Los compuestos se forman por la unión de átomos de los correspondientes elementos en una relación numérica sencilla. Los «átomos» de un determinado compuesto son a su vez idénticos en masa y en todas sus otras propiedades.
Aunque el químico irlandés HIGGINS, en 1789, había sido el primero en aplicar la hipótesis atómica a las reacciones químicas, es Dalton quien le comunica una base más sólida al asociar a los átomos la ideade masa.
Los átomos de DALTON difieren de los átomos imaginados por los filósofos griegos, los cuales los suponían formados por la misma materia primordial aunque difiriendo en forma y tamaño. La hipótesis atómica de los antiguos era una doctrina filosófica aceptada en sus especulaciones científicas por hombres como GALILEO, BOYLE, NEWTON, etc., pero no fue hasta DALTON en que constituye una verdadera teoría científica mediante la cual podían explicarse y coordinarse cuantitativamente los fenómenos observados y las leyes de las combinaciones químicas.
Niels Bohr
Bohr unió la idea de átomo nuclear de Rutherford con las ideas de una nueva rama de la Ciencia: la Física Cuántica. Así, en 1913 formuló una hipótesis sobre la estructura atómica en la que estableció tres postulados:
¤ El electrón no puede girar en cualquier órbita, sino sólo en un cierto número de órbitas estables. En el modelo de Rutherford se aceptaba un número infinito de órbitas.
¤ Cuando el electrón gira en estas órbitas no emite energía.
¤ Cuando un átomo estable sufre una interacción, como puede ser el imapacto de un electrón o el choque con otro átomo, uno de sus electrones puede pasar a otra órbita estable o ser arrancado del átomo.
El átomo de hidrógeno según el modelo atómico de Bohr
¤ El átomo de hidrógeno tiene un núcleo con un protón.
¤ El átomo de hidrógeno tiene un electrón que está girando en la primera órbita alrededor del núcleo. Esta órbita es la de menor energía.
¤ Si se le comunica energía a este electrón, saltará desde la primera órbita a otra de mayor energía. cuando regrese a la primera órbita emitirá energía en forma de radiación luminosa.
En la siguiente simulación puedes elegir la órbita de giro del electrón. Observa cómo las energías de las órbitas más exteriores son mayores que las de las órbitas más interiores. "r" es el radio de la órbita.
Arnod Sommerfeld
El modelo de Bohr funcionaba muy bien para el atomo de hidrgeno. En los espectros realizados para otros atomos se observaba que electrones de un mismo nivel energetico tenian distinta energia. Algo andaba mal. La conclusion fue que dentro de un mismo nivel energetico existan subniveles.
En 1916, Arnold Sommerfeld modifica el modelo atómico de Bohr, en el cual los electrones solo giraban en orbitas circulares, al decir que tambien podian girar en orbitas elipticas.
Todavia Chadwick no habia descubierto los neutrones, por eso en el nucleo solo se representan, en rojo, los protones.
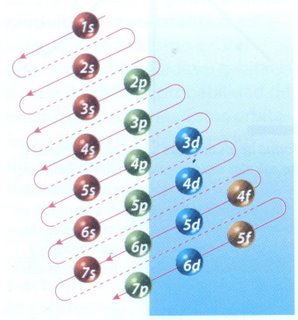
Este conocimiento dio lugar a un nuevo numero cuantico: “el numero cuantico azimutal”, que determina la forma de los orbitales, se lo representa con la letra “ l “ y toma valores que van desde 0 hasta n-1.
Valor Subnivel “ l “ Nombre
0 s sharp
1 p principal
2 d diffuse
3 f fundamental
Sommerfeld perfecciono el modelo at¨®mico de Bohr intentando paliar los dos principales defectos de este.
Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postula que el nucleo del atomo no permanece inmovil, sino que tanto el nucleo como el electron se mueven alrededor del centro de masas del sistema, que estara situado muy proximo al nucleo.
Joseph John Thompson
El modelo atómico de Thomson, es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, descubridor del electrón en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como un puding de pasas. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una sopa de carga negativa se postulaba con una nube de carga positiva.
Ernest Rutherford
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva.
El módelo atómico de Rutherford puede resumirse de la siguiente manera:
Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m). El hecho de que el núcleo tenga un diámetro unas diez mil veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
Para analizar cual era la estructura del átomo, Rutherford diseñó un experimento:
El experimento consistía en bombardear una fina lámina de oro con partículas alfa (núcleos de helio). De ser correcto el modelo atómico de Thomson, el haz de partículas debería atravesar la lámina sin sufrir desviaciones significativas a su trayectoria. Rutherford observó que un alto porcentaje de partículas atravesaban la lámina sin sufrir una desviación apreciable, pero un cierto número de ellas era desviado significativamente, a veces bajo ángulos de difusión mayores de 90 grados. Tales desviaciones no podrían ocurrir si el modelo de Thomson fuese correcto.
La suma de las cargas eléctricas negativas de los electrones debe ser igual a la carga positiva del núcleo, ya que el átomo es eléctricamente neutro.Los electrones giran a grandes distancias alrededor del núcleo en órbitas circulares.El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo.